Die nicht essentielle Aminosäure L-Glutamin gilt als die „Wunderwaffe“ für den Darm. Was aber, wenn das Wunder nicht eintritt? Und du im Gegenteil eine L-Glutamin Unverträglichkeit hast? Biochemie-Expertin Nadine von body.chem ist auf Spurensuche gegangen, und hat mögliche Ursachen für´s Desaster zusammengefasst.
Let’s start at the beginning, bevor wir zur L-Glutamin Unverträglichkeit kommen. Und zwar mit der Frage: Was ist Glutamin, oder besser L-Glutamin überhaupt? Eine nicht-essentielle Aminosäure. Die von allen Aminosäuren in unserem Körper übrigens am häufigsten vorkommt. Was kann sie so? Sie spielt eine wichtige Rolle bei der Umwandlung von Aminosäuren, reguliert die Zell- und Immunmodulation, hat einen positiven Effekt auf den Glukosestoffwechsel, verstärkt die Glutathionbildung und ist an der Osmoregulation beteiligt. Was genau führt zu einem starken Mangel in unserer Muskulatur? Beispielsweise Operationen, Traumata, Entzündungen oder eine Sepsis.
L-Glutamin: Die viel gepriesene Darm-Wunderwaffe
Wie ist nun aber die Sache mit der Darm-Wunderwaffe zu verstehen? Nun: Glutamin ist ein wichtiger Nährstoff für Immunzellen und für Enterozyten (Darmzellen). Die Aminosäure kann die Darmschleimhaut stärken, während ein Mangel die Darmbarriere schwächt. Bei Erkrankungen wird Glutamin vermehrt verbraucht. Führt man es oral zu, kann es zu einer Steigerung der Glutathionsynthese im Darm beitragen. Was insofern gut ist, weil Glutathion eines der wichtigsten Antioxidantien in unserem Körper ist.1, 2 Abgesehen davon gibt es Hinweise darauf, dass Glutamin im Darm die Konzentration entzündungsfördernder Zytokine senken und den Gehalt antientzündlicher Zytokine erhöhen kann.3 Zytokine sind Botenstoffe, die bei einer Reaktion des Immunsystems gebildet werden.
Hast du eine L-Glutamin Unverträglichkeit? Mögliche Ursachen
Zuerst die gute Nachricht: In Studien mit gesunden Probanden führten L-Glutamin-Gaben bis 30 g täglich zu keinen nennenswerten Nebenwirkungen. Für die Langzeiteinnahme gibt es jedoch kaum Daten. Und tatsächlich berichten immer wieder Menschen mit chronischen Erkrankungen in Selbsthilfegruppen über eine Unverträglichkeit gegenüber dieser Aminosäure. Was sagt die Literatur dazu? Es finden sich zwar wenige Fälle, die über die Sicherheit bzw. Nebenwirkungen von Glutamin berichten. Was es aber sehr wohl gibt, sind einige kleinere Studien zum Thema:
Studien zum Thema Sicherheit/Nebenwirkungen von L-Glutamin
In einer Studie mit 16 Kindern mit Morbus Crohn, mussten 2 Probanden die Teilnahme wegen Unverträglichkeitsreaktionen abbrechen. Sie erhielten 3 x täglich 7 g L-Glutamin. Im Vergleich zur Kontrollgruppe führte die Glutamin-Ergänzung zu keinen nennenswerten Verbesserungen der Darmpermeabilität (Darmdurchlässigkeit).4
In einem Colitis-Tiermodell mit Ratten kam es bei der Gruppe mit einer Ergänzung von 24 g Glutamin / 100 g Proteinpulver zu einer Verstärkung der Darmentzündung.5
In einer weiteren Studie an Ratten erhöhte die Glutamingabe zusammen mit Fetten aus der Nahrung die Mastzellaktivität der Darmschleimhaut. Dies führte zu einer vermehrten Ausschüttung entzündungsfördernder Botenstoffe.6
Was könnte nun aber hinter einer L-Glutamin Unverträglichkeit gegenüber L-Glutamin stecken?
1. Glutamat-GABA-Dysbalance: Wenn dein Nervensystem überreagiert
Aminosäuren können die Blut-Hirn-Schranke (BHS) überqueren. Normalerweise sind Aminosäurekonzentrationen im Blut aber 10-mal höher als die Spiegel im Gehirn. Eine Ausnahme ist Glutamin. Hier liegen die Konzentrationen im zentralen Nervensystem und in der Peripherie etwa gleichermaßen verteilt vor. Glutamin ist die Vorstufe der Neurotransmitter Glutamat und γ-Aminobuttersäure (GABA). Unter bestimmten Voraussetzungen sind L-Glutamin, Glutamat und GABA über verschiedene Wege ineinander umwandelbar.
Glutamat
Aus L-Glutamin wird über das Enzym Glutaminase das Molekül Glutaminsäure gebildet. Im Körper kommt Glutaminsäure hauptsächlich in seiner ionischen Form Glutamat vor.
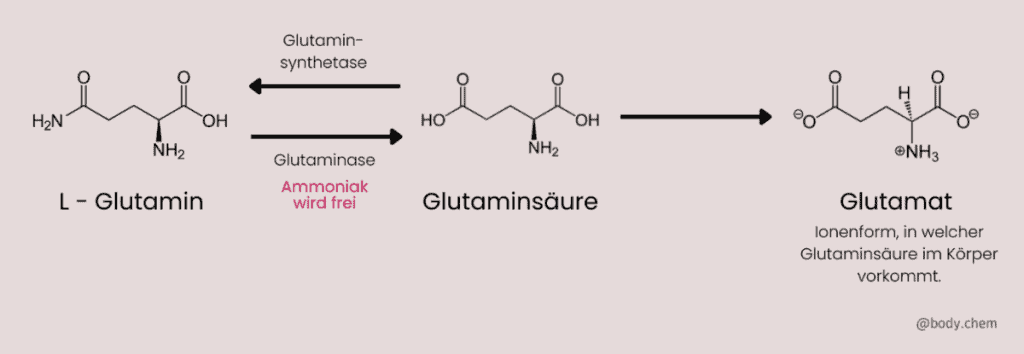
Glutamat ist der am häufigsten vorkommende exzitatorische (erregende) Neurotransmitter. Wir benötigen ihn zum Lernen, für unser Gedächtnis, für die Konzentration, für die Wahrnehmung, zur Stimmungsregulation und zu Aufrechterhaltung des Energieniveaus. Glutamat ist außerdem sehr wichtig für die Neuroplastizität, die bei der Anpassung an Umweltstressoren benötigt wird.7 Durch zu viel Glutamat werden allerdings reaktive Sauerstoffspezies (ROS) gebildet, die oxidativen Stress verursachen und neurologische Störungen auslösen können. Dies kann neurotoxisch wirken und Zellschäden, sowie Zelltod auslösen.7
Gaba
GABA entsteht durch das Enzym Glutaminsäure-Decarboxylase (GAD) aus Glutamat.8

GABA ist der wichtigste inhibitorische (hemmende) Neurotransmitter im zentralen Nervensystem (ZNS). Seine Konzentration im ZNS ist bis zu 1.000-mal höher als die der Mono-Amin-Neurotransmitter (Serotonin, Dopamin, Adrenalin, Noradrenalin).8 GABA wirkt angstlösend, beruhigend und schmerzlindernd.
Mögliche Faktoren für eine Störung der Glutamat-GABA-Achse
Liegen bestimmte Faktoren vor, ist es möglich, dass es zu einer Dysbalance der Glutamat-GABA-Achse kommen bzw. diese verstärkt werden kann. Bei einem zu hohen Glutamatspiegel kann es zu gesundheitlichen Beschwerden kommen, die im Zusammenhang mit einer Übererregbarkeit des Nervensystems stehen. Dies kann sich z.B. in Angst- und Unruhezuständen und/oder erhöhter Schmerzwahrnehmung zeigen. Zudem finden sich immer mehr Hinweise darauf, dass eine veränderte GABA-Signalgebung mit neurologischen und psychiatrischen Störungen zusammenhängen, wie z.B. Schlafstörungen, Lernverhalten, Entwicklungsstörungen, Epilepsie, Drogenabhängigkeit (z.B. Alkoholismus), Schizophrenie und motorische Koordinationsstörungen (z.B. Parkinson).8
Ursachen, die bei Glutamineinnahme zu einer Glutamin-GABA-Dysbalance führen könnten:
- Genetische Variante des GAD-Gens, die Glutamat nicht ausreichend in GABA umwandeln kann29
- Vitamin B6-Mangel, der dafür sorgt, dass am GAD-Enzym ein Kofaktor-Mangel herrscht, wodurch zu wenig GABA gebildet wird29
- Zink-Mangel: Ohne Zink kann Vitamin B6 nicht in die aktive Form Pyridoxal-5‘-phosphat (P5P) überführt werden. Die Einnahme von aktivem Vitamin B6 verändert dies nicht. Für die Aufnahme in den Körper benötigt auch P5P eine zinkabhängige Umwandlung. Zinkmangel kann zu einem funktionellen Vitamin B6-Mangel führen, der sich in erhöhten Vitamin B6-Blutwerten zeigen kann (Erhöhte Werte ohne Vitamin B6-Supplementation).9
- (Chronischer) Stress7
- Hoher oxidativer Stress7
- Zu hoher Manganspiegel10
- Blei-Belastung11
2. Eine Darm-Dysbiose und Histaminabbaustörung
L-Glutamin kann enzymatisch zu den biogenen Aminen (BA) Putrescin, Spermidin und Spermin umgewandelt werden. BA umfassen Substanzen, die durch lebende Organismen aus Aminosäuren gebildet werden können. Der bekannteste Vertreter der biogenen Amine ist Histamin, welches aus der Aminosäure Histidin entsteht. BA können sich in ihrer Wirkung gegenseitig verstärken. Erhöhte BA-Konzentrationen stehen im Zusammenhang mit einer Darmflora-Fehlbesiedlung. Dabei kommt es durch bestimmte Bakterienarten, wie z.B. E. coli, Enterobakterien, Klebsiella, Pseudomonas u.v.m. zu einer gesteigerten BA-Bildung. Das kann zu einer geringeren Toleranzgrenze gegenüber BA in Lebensmitteln beitragen (z.B. Histamin, Tyramin, Cadaverin, Putrescin).12–14
Wirkungen der genannten Biogenen Aminen
- Putrescin: Verstärkung der Histaminwirkung; starke Hemmung des Histaminabbaus über das Enzym Diaminoxidase (DAO)13,15
- Spermin und Spermidin: leichte bis moderate Hemmung des Histaminabbaus über das Enzym Diaminoxidase15
Bei einer Fehlbesiedlung der Darmflora und einer gleichzeitigen Störung des Histaminabbaus können biogene Amine somit zu gesundheitlichen Beschwerden führen und auch die Symptome einer Histaminintoleranz verstärken.

3. Ammoniakbelastung: Wenn dein Körper L-Glutamin nicht abbaut
Bei der Umwandlung von L-Glutamin zu Glutaminsäure entsteht Ammoniak. Dieser wird über die Leber zu Harnstoff abgebaut. Bei Überlastung der Harnstoffsynthese kann Ammoniak nicht mehr ausreichend metabolisiert werden und reichert sich an. Dies kann auch bei Leberfunktionsstörungen der Fall sein. Ammoniak ist ein starkes Neurotoxin, dessen Konzentration im Blut messbar ist.16,17 Ein erhöhter Ammoniak-Spiegel wird auch Hyperammonämie genannt und kann sich anhand folgender Symptome zeigen:17,18
- Brainfog
- Kopfschmerzen
- Lethargie
- Fieber
- Appetitlosigkeit
- Übelkeit, Erbrechen
- Psychosen
Da ein großer Teil des Ammoniaks im Darm entsteht, ist es wichtig einen genauen Blick auf die Darmgesundheit zu werfen. Mit Bindemitteln, wie z.B. Aktivkohle, kann Ammoniak im Darm gebunden werden. Dadurch kann das Molekül nicht mehr ins Blut gelangen und muss auch nicht abgebaut werden.
Substanzen, die den Abbau von Ammonik unterstützen
Zudem gibt es auch Substanzen, die den Abbau von Ammoniak unterstützen können. Dies sind zum Beispiel:
- Biotin19,20
- Alpha Ketoglutarat21
- Arginin22 (Achtung: daraus können biogene Amine gebildet werden)
- Ornithin22 (Achtung: daraus können biogene Amine gebildet werden)

4. Entzündung durch Glutamin? Die Rolle des Immunsystems
Wie in der Einleitung bereits erwähnt, gibt es eine Studie im Rattenmodell, bei der es durch die gleichzeitige Gabe von L-Glutamin und Fettsäuren zu einer Steigerung der Mastzellaktivität im Darm kam. Daraus ergab sich eine erhöhte Freisetzung von Entzündungsbotenstoffen wie Histamin, Protease II und Prostaglandin D2.6 Eine solche Studie besitzt keine sehr hohe Beweiskraft dafür, dass dieser Mechanismus auch bei Menschen so möglich ist. Aber falls die Ursache der Unverträglichkeit auf Glutamin an einer Mastzellaktivierung liegen würde, dann könnte eventuell die Einnahme von Glutamin getrennt von Mahlzeiten (wegen Fettsäuren) von Vorteil sein. Auch eine Mastzellstabilisierung könnte zu einer besseren Verträglichkeit beitragen. Natürliche Mastzellstabilisatoren können sein:
- Quercetin23,24
- Rutin23,25
- Lactoferrin26,27
- Vitamin D328
5. Mastzellen, Mikroglia & Glutamat: Ein gefährliches Trio
In Form seines Metaboliten Glutamat kann Glutamin Effekte auf Immunzellen haben (Infos zur Umwandlung von Glutamin zu Glutamat siehe Abschnitt weiter oben).

Mastzellen befinden sich nicht nur in peripheren Geweben, sondern auch im zentralen Nervensystem (ZNS).29 Daneben gibt es im ZNS noch eine weitere wichtige Art von Immunzellen: Mikroglia.30 Mikroglia erfüllen Funktionen zum Schutz des Gehirns, können aber bei übermäßiger Stimulation auch Krankheiten auslösen. Mikroglia interagieren stark mit den Mastzellen im ZNS. Dieses Zusammenspiel kann bei gesteigerter Mastzellaktivierung dazu führen, dass auch Mikroglia vermehrt aktiviert werden und ebenfalls ihre entzündungsfördernden Botenstoffe ausschütten.31
Gerade bei Personen, die aufgrund einer Mastzellerkrankung vermehrt von neurologischen Symptomen betroffen sind, könnten auch aktivierte Mikroglia involviert sein. Eine Stabilisierung der Mastzellen kann daher auch wichtig sein, um die entzündungsfördernde Kommunikation zu anderen Zellen zu drosseln. Glutamat ist als erregender Neurotransmitter auch in der Lage Mastzellen und Mikroglia zu stimulieren. Eine zu hohe Glutamatkonzentration wirkt neurotoxisch auf Mikroglia und kann bei Mastzellen zu einer Ausschüttung von entzündungsfördernden Zytokinen, wie z.B. Interleukin 6 führen.32 Störungen der Mikroglia sind mit nahezu allen Erkrankungen des ZNS verbunden.33
Wenn du L-Glutamin nicht verträgst: Nutze die Reaktion als Wegweiser
Du bist frustriert, weil du Glutamin gar nicht oder nur eine geringe Menge davon verträgst? Das musst du nicht. Eine Unverträglichkeit auf ein Nahrungsergänzungsmittel kann eine Chance sein, die Biochemie des Körpers besser zu verstehen und den Ursprung gesundheitlicher Beschwerden aufzudecken. Mithilfe von Beobachtungstagebüchern, Therapeuten, Blut-, Stuhl- und/oder Urintests können sich viele Ursachen herausfinden lassen. Im Falle einer Unverträglichkeit auf Glutamin, könnte es sein, dass dein Körper dir die Signale sendet, weil er zum Beispiel zu viel Stress, einen Nährstoffmangel oder eine Leberfunktionsstörung hat. Oder aber auch weil zu viele Sauerstoffradikale zu erhöhtem oxidativem Stress führen, der Histaminabbau beeinträchtigt ist, die Mastzellen zu aktiv sind oder eine Darmdysbiose besteht.
Dies sind alles Baustellen an denen man ansetzen kann, um langfristig wieder mehr Lebensqualität zu gewinnen. Das Problem ist also eigentlich gar nicht das L-Glutamin selbst. Und die Lösung dafür ist auch gar nicht das alleinige Weglassen von Glutamin, sondern die Suche nach der/den Ursache(n) dahinter.

Nadine von body.chem
kommt ursprünglich aus der medizinischen Chemie der Arzneimittelforschung, kann diesen Beruf aber seit mehreren Jahren aus gesundheitlichen Gründen nicht mehr ausüben. Auf der Ursachensuche ihrer Symptome und Erkrankungen steckt(e) sie viel Zeit in Recherchen zu biochemischen und medizinischen Themen. Sie schreibt Artikel für den Science Blog von Histameany und führt den Instagram-Account @body.chem
Literaturverzeichnis
1. van der Hulst RR, von Meyenfeldt MF, Soeters PB. Glutamine: an essential amino acid for the gut. Nutr Burbank Los Angel Cty Calif. 1996;12(11-12 Suppl):S78-81. doi:10.1016/s0899-9007(97)85206-9
2. Cao Y, Feng Z, Hoos A, Klimberg VS. Glutamine Enhances Gut Glutathione Production. J Parenter Enter Nutr. 1998;22(4):224-227. doi:10.1177/0148607198022004224
3. Coëffier M, Marion R, Ducrotté P, Déchelotte P. Modulating effect of glutamine on IL-1β-induced cytokine production by human gut. Clin Nutr. 2003;22(4):407-413. doi:10.1016/S0261-5614(03)00040-2
4. Akobeng AK, Miller V, Thomas AG, Richmond K. Glutamine Supplementation and Intestinal Permeability in Crohn’s Disease. J Parenter Enter Nutr. 2000;24(3):196-196. doi:10.1177/0148607100024003196
5. Shinozaki M, Saito H, Muto T. Excess glutamine exacerbates trinitrobenzenesulfonic acid-induced colitis in rats. Dis Colon Rectum. 1997;40(10):S59-S63. doi:10.1007/BF02062022
6. He Y, Qu J, Yang Q, Wu Z, Liu M, Tso P. Effect of L-Glutamine on Chylomicron Formation and Fat-Induced Activation of Intestinal Mucosal Mast Cells in Sprague-Dawley Rats. Nutrients. 2022;14(9):1777. doi:10.3390/nu14091777
7. Pal MM. Glutamate: The Master Neurotransmitter and Its Implications in Chronic Stress and Mood Disorders. Front Hum Neurosci. 2021;15. Accessed May 14, 2023.3
8. Olsen RW, Li GD. Chapter 18 – GABA. In: Brady ST, Siegel GJ, Albers RW, Price DL, eds. Basic Neurochemistry (Eighth Edition). Academic Press; 2012:367-376. doi:10.1016/B978-0-12-374947-5.00018-3
9. Combs GF, McClung JP. The Vitamins: Fundamental Aspects in Nutrition and Health. Sixth edition. Academic Press; 2022.
10. Sidoryk-Wegrzynowicz M. Impairment of glutamine/glutamate-γ-aminobutyric acid cycle in manganese toxicity in the central nervous system. Folia Neuropathol. 2014;52(4):377-382. doi:10.5114/fn.2014.47838
11. Struzyńska L, Sulkowski G. Relationships between glutamine, glutamate, and GABA in nerve endings under Pb-toxicity conditions. J Inorg Biochem. 2004;98(6):951-958. doi:10.1016/j.jinorgbio.2004.02.010
12. Saad MA, Abd-Rabou HS, Elkhtab E, et al. Occurrence of Toxic Biogenic Amines in Various Types of Soft and Hard Cheeses and Their Control by Bacillus polymyxa D05-1. Fermentation. 2022;8(7):327. doi:10.3390/fermentation8070327
13. Durak-Dados A, Michalski M, Osek J. Histamine and Other Biogenic Amines in Food. J Vet Res. 2020;64(2):281-288. doi:10.2478/jvetres-2020-0029
14. Pretorius L, Smith C. The trace aminergic system: a gender-sensitive therapeutic target for IBS? J Biomed Sci. 2020;27(1):95. doi:10.1186/s12929-020-00688-1
15. Sánchez-Pérez S, Comas-Basté O, Costa-Catala J, et al. The Rate of Histamine Degradation by Diamine Oxidase Is Compromised by Other Biogenic Amines. Front Nutr. 2022;9. Accessed October 19, 2023.
16. Garlick PJ. Assessment of the safety of glutamine and other amino acids. J Nutr. 2001;131(9 Suppl):2556S-61S. doi:10.1093/jn/131.9.2556S
17. Ali R, Nagalli S. Hyperammonemia. In: StatPearls. StatPearls Publishing; 2023. Accessed October 19, 2023.
18. Hyperammonämie – ein Überblick | ScienceDirect-Themen. Accessed November 2, 2023.
19. Nagamine T, Saito S, Kaneko M, et al. Effect of biotin on ammonia intoxication in rats and mice. J Gastroenterol. 1995;30(3):351-355. doi:10.1007/BF02347511
20. Nagamine T, Saito S, Yamada S, Sekiguchi T, Kobayashi S, Nakano M. [The effects of biotin on the metabolism of ammonia and amino acids in urease-induced hyperammonemic rats]. Nihon Shokakibyo Gakkai Zasshi Jpn J Gastro-Enterol. 1989;86(7):1519-1524.
21. Liu S, He L, Yao K. The Antioxidative Function of Alpha-Ketoglutarate and Its Applications. BioMed Res Int. 2018;2018:e3408467. doi:10.1155/2018/3408467
22. Tang K, Zhang H, Deng J, et al. Ammonia detoxification promotes CD8+ T cell memory development by urea and citrulline cycles. Nat Immunol. 2023;24(1):162-173. doi:10.1038/s41590-022-01365-1
23. Park HH, Lee S, Son HY, et al. Flavonoids inhibit histamine release and expression of proinflammatory cytokines in mast cells. Arch Pharm Res. 2008;31(10):1303-1311. doi:10.1007/s12272-001-2110-5
24. Jafarinia M, Sadat Hosseini M, kasiri N, et al. Quercetin with the potential effect on allergic diseases. Allergy Asthma Clin Immunol. 2020;16(1):36. doi:10.1186/s13223-020-00434-0
25. Choi JK, Kim SH. Rutin suppresses atopic dermatitis and allergic contact dermatitis. Exp Biol Med Maywood NJ. 2013;238(4):410-417. doi:10.1177/1535370213477975
26. He S, McEuen AR, Blewett SA, et al. The inhibition of mast cell activation by neutrophil lactoferrin: uptake by mast cells and interaction with tryptase, chymase and cathepsin G. Biochem Pharmacol. 2003;65(6):1007-1015. doi:10.1016/s0006-2952(02)01651-9
27. Elrod KC, Moore WR, Abraham WM, Tanaka RD. Lactoferrin, a potent tryptase inhibitor, abolishes late-phase airway responses in allergic sheep. Am J Respir Crit Care Med. 1997;156(2 Pt 1):375-381. doi:10.1164/ajrccm.156.2.9607012
28. Murdaca G, Allegra A, Tonacci A, Musolino C, Ricciardi L, Gangemi S. Mast Cells and Vitamin D Status: A Clinical and Biological Link in the Onset of Allergy and Bone Diseases. Biomedicines. 2022;10(8):1877. doi:10.3390/biomedicines10081877
29. Boddaert N, Salvador A, Chandesris MO, et al. Neuroimaging evidence of brain abnormalities in mastocytosis. Transl Psychiatry. 2017;7(8):e1197. doi:10.1038/tp.2017.137
30. Sandhu JK, Kulka M. Decoding Mast Cell-Microglia Communication in Neurodegenerative Diseases. Int J Mol Sci. 2021;22(3):1093. doi:10.3390/ijms22031093
31. Dong H, Wang Y, Zhang X, et al. Stabilization of Brain Mast Cells Alleviates LPS-Induced Neuroinflammation by Inhibiting Microglia Activation. Front Cell Neurosci. 2019;13. Accessed December 2, 2023.
32. Xu H, Shi X, Li X, et al. Neurotransmitter and neuropeptide regulation of mast cell function: a systematic review. J Neuroinflammation. 2020;17(1):356. doi:10.1186/s12974-020-02029-3
33. Domercq M, Vazquez N, Matute C. Neurotransmitter signaling in the pathophysiology of microglia. Front Cell Neurosci. 2013;7. Accessed December 2, 2023.





No Comments